БАДи та компанія: порядок приймального контролю
- Приймальний контроль харчової продукції
- Перевірка маркування харчової продукції
- Вимоги до маркування упаковки харчової продукції
- Стаття 18. ТР ТЗ 021/2011. Вимоги до процесів утилізації харчової продукції
- Пункт 7.4.8. СанПіН 2.3.2.1290-03
- Приймальний контроль парфюмерно-косметичної продукції
- Парфюмерно-косметична продукція, что підлягає державній реєстрації без Подальшого декларування відповідності...
- Ст. 6 ТР ТЗ 009/2011 Оцінка відповідності парфюмерно-косметичної продукції
- Приймальний контроль предметів та засобів по догляду за новонародженими і дітьми, які не досягли віку...
- Приймальний контроль інших груп товарів аптечного асортименту
Лариса Гарбузова про основи приймального контролю харчової продукції та парфюмерно-косметичної продукції, які необхідно вказати при написанні відповідних Сопів
До редакції «Катрен-Стиль» надходить безліч питань з приводу організації приймального контролю біологічно активних добавок, косметики та інших товарів аптечного асортименту. Розповідь про приймальному контролі зазвичай починають з лікарських засобів. Це природно, тому що саме ліки є основою аптечного асортименту. Питання ж, що стосуються приймального контролю БАД, часто знаходяться на периферії уваги лекторів. Тому спеціально для наших читачів в березні був проведений вебінар, що стосується головним чином БАД. За його підсумками ми підготували оглядовий матеріал, який розповість про основні нюанси приймального контролю і допоможе в написанні стандартної операційної процедури (СОП).
Згідно з правилами Належної аптечної практики, аптека повинна гарантувати споживачеві якість товарів, які знаходяться в обігу. Одним з механізмів такої гарантії і є приймальний контроль. Крім того що сама аптека гарантує якість продукції, вона ще повинна і мінімізувати звернення на ринку фальсифікату або просто недоброякісних товарів.
Наказ МОЗ від 31.08.2016 № 647н «Про затвердження Правил належної аптечної практики лікарських препаратів для медичного застосування», П. 44-53 НАП
У процесі приймання товарів аптечного асортименту, в тому числі що вимагають спеціальних умов зберігання і заходів безпеки, здійснюється оцінка відповідності прийнятих товарів:
- товаросопроводительной документації по асортименту, кількості і якості;
- спеціальними умовами зберігання (при наявності такої вимоги);
- перевірка наявності пошкоджень транспортної тари.

Наш експерт:
Лариса Гарбузова
к. ф. н., доцент кафедри управління та економіки фармації Північно-Західного державного медичного університету (СЗГМУ) ім. І. І. Мечникова, Санкт-Петербург
Приймальний контроль повинен бути описаний у вигляді покрокового алгоритму - стандартної операційної процедури (СОП).
Для кожної групи товарів можна написати свій окремий СОП, а можна написати один загальний, в якому буде описаний весь процес приймання товару, з примітками для видів товарів, до яких застосовуються додаткові вимоги.
У «загальному» Сопея є переваги, тому що багато процедур при приймальному контролі схожі незалежно від товарних груп, і, описавши основний процес приймального контролю, можна заощадити обсяг тексту.
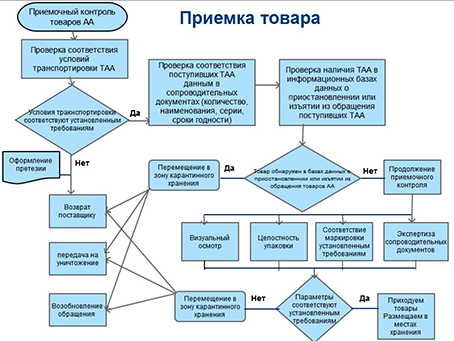
У Сопея обов'язково необхідно прописати, що прийом товару здійснюється в зоні прийому або в приміщенні для прийому. Відповідно, в аптеці необхідно мати таке приміщення (місце). У ньому повинні знаходитися піддони, подтоварники або інше обладнання, наприклад столи
Перше, що необхідно зробити при надходженні товару, це оцінити, чи дотримуються умови транспортування. В першу чергу це стосується термолабільних товарів. Це можуть бути не тільки ЛЗ, а й медичні вироби, БАДи. Якщо такі умови не дотримуються, необхідно відразу ж скласти акт, оформити претензію і повернути товар постачальнику. Для зручності в Сопея можна прописати, що приймальний контроль необхідно починати саме з термолабільних товарів.
Після термолабільних слід приступати до прийому інших типів товарів. Для зручності можна проводити приймання товару за кількістю транспортних місць або товарних одиниць, про що можна зробити позначку в супровідних документах постачальника, а потім відкривати транспортну тару самостійно, без представника постачальника.
Необхідно перевірити відповідність товарів, що надійшли даними супровідних документів: відповідність асортименту, кількості, серій (при необхідності), термінів придатності.
Далі, згідно з Правилами належної аптечної практики, потрібно перевірити за офіційними баз даних, чи не є товар припиненим або вилучених з обігу. У разі якщо є, то такий товар поміщається в карантин. Далі вже по кожній товарній групі починається перевірка якості в залежності від типу товарів.
Якщо все пройшло успішно, то товар розміщується в місцях зберігання. Не варто забувати про роздруківку стелажних карт, якщо вони не ведуться в електронному вигляді. Стелажні карти необхідні для лікарських засобів і для біологічно активних добавок. Для інших типів товарів - за бажанням.
Якщо під час приймання виникають якісь сумніви в якості товару, наприклад, порушені цілісність упаковки, вимоги щодо маркування або постачальник не привіз необхідних документів, то такий товар слід помістити в карантинну зону. Детальніше про те, як правильно організувати карантинну зону, можна прочитати в аналітичному матеріалі «Катрен-Стиль».
Варто відзначити, що карантинні зони, маркування і спосіб виділення такої зони призначаються керівником. Також керівник призначає відповідальну особу за роботу з товарами, поміщеними в карантинну зону. Тому в аптеці необхідно мати відповідні накази.
Завершальним етапом приймального контролю є ведення журналу реєстрації результатів приймального контролю. Форма такого журналу повинна бути розроблена самостійно. Вона повинна бути затверджена наказом керівника. Журнал реєстрації результатів приймального контролю може виглядати наступним чином:
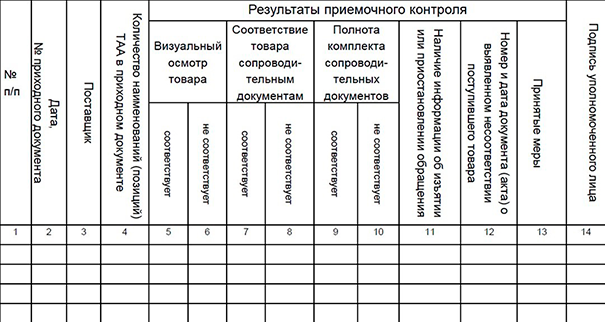
Приймальний контроль харчової продукції
Основний документ, який регулює правила поводження харчової продукції, це Технічний регламент Митного союзу ТР ТЗ 021/2011 «Про безпеку харчової продукції» .
Згідно з технічним регламентом харчова продукція аптечного асортименту відноситься до продукції, яка підлягає обов'язковій державній реєстрації.
Спеціалізована харчова продукція, що підлягає державній реєстрації:
- харчова продукція для дитячого харчування, в тому числі вода питна для дитячого харчування;
- харчова продукція для дієтичного лікувального і дієтичного профілактичного харчування;
- мінеральна природна, лікувально-столова, лікувальна мінеральна вода з мінералізацією понад 1 мг / дм3 або при меншій мінералізації, що містить біологічно активні речовини в кількості не нижчій від бальнеологічних норм;
- харчова продукція для харчування спортсменів, вагітних і жінок, що годують;
- біологічно активні добавки до їжі (БАД).
Тому в Сопея з приймального контролю важливо прописати необхідність перевірити факт державної реєстрації. Сам факт державної реєстрації - це і є підтвердження якості.
Свідоцтва про державну реєстрацію можна знайти в наступних реєстрах:
Є один нюанс, пов'язаний з вимогами належної аптечної практики, в яких зазначено, що якість харчової продукції разом зі свідоцтвом про державну реєстрацію повинно підтверджуватися декларацією відповідності. Ця вимога суперечить чинному законодавству, оскільки сам факт державної реєстрації харчової продукції вже є підтвердженням якості (стаття 21 Технічного регламенту ТР ТЗ 021/2011). Швидше за все, це помилка, яка буде усунена незабаром .
Зверніть увагу, в технічному регламенті сказано, що харчова продукція могла здійснюватися за раніше діючим вимогам. Це стосується харчової продукції, виробленої до 15 лютого 2015 року. У цьому випадку така харчова продукція дійсно повинна бути супроводжена декларацією відповідності. Визначити такий товар можна за маркуванням:
Проведена і надійшла в обіг відповідно до раніше діючими Вимогами (до 15.02.2015 або для дитячих сухих молочних сумішей до 31.12.2015 г) проведена і надійшла в обіг відповідно до Вимог ТР ТЗ 021/2011
маркування

маркування

Потрібно декларація про відповідність Не потрібно декларації про відповідність
Варто пам'ятати, що товар не може бути одночасно промаркований двома такими знаками (ЕАС і РСТ). Якщо на упаковці присутні обидва варіанти маркування, то необхідно звернутися за роз'ясненнями до постачальника і виробника.
Крім вказівки на упаковці, необхідність декларування можна перевірити в свідоцтві про реєстрацію. У свідоцтві про реєстрацію буде вказано, яким вимогам відповідає продукція: Технічного регламенту або Єдиним санітарно-епідеміологічним і гігієнічним вимоги. Відповідно, так можна визначити, чи потрібно додатково декларування відповідності товару.
Перевірка маркування харчової продукції
Вимоги щодо маркування харчової продукції містяться в Технічний регламент ТЗ 022/2011 .
Обов'язкові вимоги до маркування харчової продукції:
- найменування харчової продукції;
- склад харчової продукції;
- кількість харчової продукції;
- дата виготовлення харчової продукції;
- термін придатності харчової продукції;
- умови зберігання харчової продукції (для харчової продукції, якість і безпека якої змінюється після відкриття упаковки, яка захищала продукцію від псування, вказують також умови зберігання після відкриття упаковки);
- найменування і місце знаходження виробника харчової продукції або ПІБ і місце знаходження індивідуального підприємця-виробника харчової продукції, а також у випадках, встановлених цим ТР ТЗ, найменування та місце знаходження уповноваженого виробником особи, найменування і місце знаходження організації-імпортера або ПІБ і місце знаходження індивідуального підприємця-імпортера;
- рекомендації та (або) обмеження щодо використання;
- показники харчової цінності харчових продуктів;
- відомості про наявність в харчовій продукції компонентів, отриманих із застосуванням генно-модифікованих організмів (далі - ГМО);
- єдиний знак обігу продукції на ринку держав - членів Митного союзу
На споживчому пакуванні або етикетці повинні бути такі обов'язкові відомості:
Вимоги до маркування харчової продукції ТС 022/2011
- найменування харчової продукції;
- дата виготовлення харчової продукції;
- термін придатності харчової продукції;
- умови зберігання харчової продукції (для харчової продукції, якість і безпека якої змінюється після відкриття упаковки, яка захищала продукцію від псування, вказують також умови зберігання після відкриття упаковки)
Крім цього, якщо харчова продукція може викликати алергію, то така інформація є обов'язковим до нанесення. Інша обов'язкова інформація може не вказуватися на етикетці, вона може бути представлена на листку-вкладиші
Також щодо біологічно активних добавок існує окремий СанПіН, також встановлює вимоги до необхідної інформації, що наноситься на етикетку БАД. Потрібно звернути увагу на виділені фрагменти, яких немає у вимогах Технічного регламенту.
Постанова Головного держ. сан. лікаря РФ від 17.04.2003 р № 50 Санітарно-епідеміологічні правила і нормативи «Гігієнічні вимоги до організації виробництва і обороту біологічно активних добавок до їжі (БАД)» СанПіН 2.3.2.1290-03
Найменування БАД, і зокрема:
- товарний знак виробника (за наявності);
- позначення нормативної або технічної документації, вимогам яких повинні відповідати БАД (для БАД вітчизняного виробництва та країн СНД);
- склад БАД із зазначенням інгредіентному складу в порядку, відповідному їх зменшенням у ваговому або процентному вираженні;
- відомості про основні споживчі властивості БАД;
- відомості про вагу або обсязі БАД в одиниці споживчої упаковки і вазі або об'ємі одиниці продукту;
- відомості про протипоказання для застосування при окремих видах захворювань;
- вказівка, що БАД не є ліками;
- дата виготовлення, гарантійний термін придатності або дата кінцевого терміну реалізації продукції;
- умови зберігання;
- інформація про державну реєстрацію БАД із зазначенням номера та дати;
- місце знаходження, найменування виробника (продавця) і місце знаходження та телефон організації, уповноваженої виробником (продавцем) на прийняття претензій від споживачів.
Росспоживнагляд під час проведення заходів щодо виробництва і обороту БАД особливу увагу звертає на відповідність змісту етикеткової написи продукту вимогам, викладеним в свідоцтві про державну реєстрацію. Крім того, звертає увагу на інгредіентний склад, показання та протипоказання до застосування БАД. І в разі порушення в першу чергу штрафують саме аптеки, як перша ланка ланцюга обороту.
Тому при приймальному контролі не варто сподіватися тільки на наявність свідоцтва про державну реєстрацію. Необхідно звіряти дані, зазначені в етикетці, з даними з реєстру. Зрозуміло, що фізично це дуже складно. Але робити це треба. Хоча б вибірково.
Крім вимог до маркування самої харчової продукції існують вимоги до маркування упаковки.
Вимоги до маркування упаковки харчової продукції
Вимоги до маркування упаковки харчової продукції містяться в Технічний регламент ТЗ «Про безпеку упаковки» ТР ТЗ 005/2011
Технічний регламент ТЗ «Про безпеку упаковки» ТР ТЗ 005/2011 прийнятий Рішенням Комісії МС № 769 від 16.08.2011 р
Маркування упаковки (закупорювальних засобів) повинна містити:
Цифрове (буквене) позначення матеріалу і відповідні піктограми можуть зазначатися не тільки на самій упаковці, але і (або) в супровідних документах на упаковку.
На упаковку, яка випускалася в обіг на території Митного союзу і не виготовлялася виробником продукції в процесі виробництва, вимоги технічного регламенту ТР ТЗ 005/2011 не поширюються (Лист Росспоживнагляду від 29.10.2015 № 01 / 13186-15-31). Таким чином, якщо продукція надходить з-за кордону в якості готової продукції (виготовлення продукції і її упаковка здійснюються не на території Митного союзу і виробник продукції не виготовляє упаковку, а закуповує її не на території Митного союзу), то на упаковці не повинні бути нанесені піктограми і цифрове (буквене) позначення матеріалу.
У разі якщо харчова продукція не відповідає вимогам, вона підлягає вилученню з обороту.
Зберігання та утилізація неякісної харчової продукції
Стаття 18. ТР ТЗ 021/2011. Вимоги до процесів утилізації харчової продукції
Утилізації підлягає харчова продукція, яка не відповідає вимогам Технічного регламенту та (або) технічних регламентів Митного союзу на окремі види харчової продукції.
Така харчова продукція до проведення її утилізації повинна зберігатися за умов, що виключають можливість несанкціонованого доступу до неї, і підлягати обліку.
Пункт 7.4.8. СанПіН 2.3.2.1290-03
Вилучена продукція до її використання, утилізації або знищення підлягає зберіганню в окремому приміщенні (шафі), на особливому обліку, з точним зазначенням її кількості. Відповідальність за збереження цієї продукції несе власник.
При переміщенні в карантинну зону обов'язково складання акта, де будуть вказані причини переміщення, терміни та інша необхідна інформація.
Інформацію про призупинення обігу того чи іншого виду товарів можна знайти на сайті Державного інформаційного ресурсу в сфері захисту прав споживачів в розділі «Відомості про факти порушення вимог технічних регламентів» . Крім цього, має сенс щодня заходити на головну сторінку Росспоживнагляду в розділи «Документи» і «Прес-служба», де публікуються листи або накази Росспоживнагляду з рішеннями про призупинення або вилучення продукції з обігу.
Приймальний контроль парфюмерно-косметичної продукції
Оборот парфюмерно-косметичної продукції (ПКП) регулюється Технічним регламентом Митного союзу ТР ТЗ 009/2011 «Про безпеку парфумерно-косметичної продукції» . При прийманні деяких типів косметичної продукції також потрібно впевнитися у факті державної реєстрації.
Парфюмерно-косметична продукція, что підлягає державній реєстрації без Подальшого декларування відповідності (ст. 6 та додаток 12 ТР ТЗ 009/2011)
- Парфюмерно-косметична продукція для штучної засмаги
- Парфюмерно-косметична продукція для відбілювання (освітлення) кожи
- Косметика для татуажу
- Інтимна косметика
- ПКП індивідуального захисту кожи від впліву шкідливих виробничих факторів
- ПКП для хімічного фарбування, освітлення та мелірування волосся
- Парфюмерно-косметична продукція для хімічної завивки и розпрямлення волосся
- ПКП, Вироблено з Використання наноматеріалів
- Парфюмерно-косметична продукція для депіляції
- пілінги
- Фторсодержащие засоби гігієні порожніні рота, масова Частка фторідів в якіх перевіщує 0,15% (для рідкіх ЗАСОБІВ Засоби для відбілювання зубів, Які містять перекис водних або інші компоненти, что віділяють перекис водних, включаючі перекис карбаміду и перекис цинку, з концентрацією перекису водно ( в якості інгредієнта або віділеної) 0,1-6,0%.
Варто відзначити, що інша косметична продукція повинна надходити в аптеку із зазначенням відомостей про наявність декларації про відповідність:
Ст. 6 ТР ТЗ 009/2011 Оцінка відповідності парфюмерно-косметичної продукції
Парфюмерно-косметична продукція, що підлягає декларуванню відповідності:
- декоративна косметика;
- косметика по догляду за обличчям, тілом, волоссям. нігтями для дорослих, мило туалетне, засоби для гоління, дезодоруючі засоби;
- засоби по догляду за зубами і порожниною рота (крім тих, які підлягають державній реєстрації: фторвмісні, засоби для відбілювання зубів з перекисом водню).
До 1 липня 2014 парфюмерно-косметична продукція могла здійснюватися за раніше діючим вимогам, відповідність такої продукції підтверджувалося декларацією про відповідність. Визначити це можна так само, як і в разі харчової продукції з маркування.
Проведена і надійшла в обіг відповідно до раніше действующіміТребованіямі (до 01.07.2014) проведена і надійшла в обіг відповідно до Вимог ТР ТЗ 021/2011
маркування

маркування

Потрібно декларація про відповідність Не потрібно декларації про відповідність для парфюмерно-косметичної продукції, зазначеної в додаток 12 ТР ТЗ 009/2011
Вимоги до маркування косметичної продукції містяться в пункті 9 статті 5 ТР ТЗ 009/2011.
Маркування упаковки ВКП аналогічна загальним вимогам «Про безпеку упаковки». Від харчової продукції вона відрізняється лише піктограмою з зображенням пудрениці і дзеркала.
Технічний регламент ТЗ «Про безпеку упаковки» ТР ТЗ 005/2011 прийнятий Рішенням Комісії МС № 769 від 16.08.2011 р
Маркування упаковки (закупорювальних засобів) повинна містити:
- цифрове позначення і (або) буквене позначення (абревіатуру) матеріалу, з якого виготовляється упаковка (закупорювальні засоби), згідно з додатком 3 до TP ТЗ 005/2011
- піктограми і символи згідно з додатком 4 до TP ТЗ 005/2011

До 15.02 2014 допускалося виробництво і випуск в обіг продукції відповідно до раніше діючих вимог (в т. Ч. Без даних піктограм)
Приймальний контроль предметів та засобів по догляду за новонародженими і дітьми, які не досягли віку 3 років
Предмети і засоби по догляду за маленькими дітьми регулюються Технічним регламентом Митного союзу ТР ТЗ 007/2011 «Про безпеку продукції, призначеної для дітей та підлітків» .
Вимоги до маркування продукції згідно зі ст. 9 ТР ТЗ 007/2011 (основні моменти)
Маркування продукції повинна містити наступну інформацію:
- Інформація повинна бути представлена на російській мові або державною мовою держави - члена Митного союзу, на території якого даний виріб виробляється і реалізується споживачу.
Для імпортної продукції допускається найменування країни, де виготовлена продукція, найменування виробника та його юридична адреса вказувати з використанням латинського алфавіту.
- Не допускається використання вказівок «екологічно чиста», «ортопедична» та інших аналогічних вказівок без відповідного підтвердження.
- Маркування сосок молочних і сосок-пустушок повинна наноситися на закриту упаковку і містити гарантійний термін служби, інструкцію з використання, зберігання, гігієнічному догляду за виробом.
- Вироби санітарно-гігієнічні разового використання для догляду за дітьми повинні мати інструкцію, яка містить інформацію із зазначенням призначення, розміру, рекомендацій щодо правильного вибору виду і розміру вироби, способів догляду за виробом і його утилізації (при необхідності).
- Маркування посуду і виробів санітарно-гігієнічних і галантерейних повинна містити позначення матеріалу, з якого виготовлено виріб, і інструкцію по експлуатації та догляду.
Вироби, за формою і видом аналогічні вживаним виробам для харчових продуктів, але не призначені для контакту з харчовими продуктами, повинні мати маркування «Для нехарчових продуктів» або вказівку їх конкретного призначення.
Не варто забувати, що окремі товари для дітей вимагають обов'язкової реєстрації з подальшим декларуванням, інші ж просто підлягають сертифікації.
Державна реєстрація з наступним декларуванням відповідності:
- соски молочні
- соски-пустушки з латексу, гуми або силіконові;
- дитячий посуд, столові прилади для дітей до 3 років;
- вироби санітарно-гігієнічні разового користування (підгузники, труси, пелюшки);
- щітки зубні дитячі
(До 01.07.2012 дані товари підлягали сертифікації)
Обов'язкова сертифікація:
- коляски;
- вироби санітарно-гігієнічні: з гуми формові і неформові; із пластмас і металу для догляду за дітьми
(До 01.07.2012 підлягали декларуванню)
Приймальний контроль інших груп товарів аптечного асортименту
Серед іншого аптечного асортименту варто виділити товари, що підлягають декларуванню. согласно Постановою Уряду РФ № 982 від 01.12.2009 , До таких товарів належать:
- засоби дезінфікуючі, дезінсекційних, дератизаційні;
- вироби санітарно-гігієнічного та медичного призначення разового користування (прокладки (пакети) жіночі гігієнічні, рушники паперові, хустки носові паперові та ін.);
- предмети і засоби для догляду за хворими (грілки гумові, бульбашки гумові для льоду, трубки мед. гумові, клейонка подкладная резинотканевая - крім засобів по догляду за дітьми і підлітками);
- щітки зубні дорослі.
За більш детальною інформацією про обов'язкову реєстрацію, маркування та інших вимогах при продажу цих товарів, необхідно звернутися до Єдиним санітарно-епідеміологічним і гігієнічним вимогам до товарів, що підлягають санітарно-епідеміологічному нагляду (контролю) .
На закінчення варто нагадати, що не вся продукція на ринку піддається обов'язковій реєстрації і декларіровнію.
Стаття 46 Федерального закону від 27.12.2002 № 184-ФЗ «Про технічне регулювання»:
3.1 Продукція, на яку не поширюється дія технічних регламентів і яка при цьому не включена ні в один з переліків (продукції, що підлягає сертифікації або підлягає декларуванню), не підлягає обов'язковому підтвердженню відповідності.
БАДи, косметика і медичні вироби є лише частиною асортименту аптечних товарів. Основна ж продукція в аптеках - це лікарські засоби. Про особливості приймального контролю ЛЗ, нюансах і про те, як правильно скласти СОП по їх приймання, «Катрен-Стиль» розповість найближчим часом.