напівпровідники
Напівпровідники, речовини, які характеризуються збільшенням електричної провідності з ростом температури. Хоча часто напівпровідники визначають як речовини з питомою електричну провідність а, проміжною між її значеннями для металів (σ = 106 -104 Ом-1 см-1) і для хороших діелектриків (σ = -12 - 10-10 Ом-1 см-1 ), сама величина електричної провідності не грає визначальної ролі в напівпровідникових властивості речовини. На електричну провідність П впливає крім температури сильне електричне поле, тиск, вплив оптичного та іонізуючого випромінювання, наявність домішок та інші чинники, здатні змінювати структуру речовини і стан електронів. Ця обставина грає вирішальну роль в численному і різноманітному використанні напівпровідників.
Напівпровідникові властивості можуть спостерігатися як в кристалічних речовинах, так і в невпорядкованих системах - твердих аморфних речовинах (стеклах) і рідинах. При цьому вирішальним є характер хімічного зв'язку між частинками в ближньому порядку (перша координаційна сфера). Існують напівпровідники з будь-яким типом хімічного зв'язку, крім чисто металевою і чисто іонної (тобто ковалентного, ковалентно-металевої, ковалентно-іонної і т.п.), причому ковалентная складова зв'язку є зазвичай переважаючою. Широке практичне застосування отримали напівпровідники, які є простими речовинами (Ge, Si і ін.), А також хімічні сполуки елементів III групи періодичної системи з елементами V групи, наприклад GaAs, GaP, InAs, CdTe і т.п. (бінарні напівпровідники). Всі такі речовини мають кристалічну решітку, подібну решітці алмазу, і називаються алмазоподібних напівпровідників. У Ge і Si в кристалічному стані реалізується класична двухелектронная ковалентний зв'язок, утворена перекриванням sp 3-гібридних орбіталей сусідніх атомів (див. Гібридизація атомних орбіталей ). Відповідно до симетрією sp 3-гібридних орбіталей розташування атомів в першій координаційній сфері відповідає правильного тетраедра. Така ж перша координаційна сфера і у алмазоподібних напівпровідників, проте в їх структурі кожна ковалентний зв'язок має ковалентно-іонний характер через помітну різниці електронегативності сусідніх атомів.
Підвищення температури, а також інших зовнішнього впливу (опромінення світлом або сильне електричне поле) можуть викликати розрив ковалентного зв'язку, іонізацію атомного остова і освіту вільного електрона. Цей електрон в умовах безперервного обміну валентними електронами між атомами кристала може переходити з комірки в комірку і переносити з собою негативний заряд, який всюди є надлишковим, тобто вільний електрон стає електроном провідності. Недолік електрона у розірваній ковалентного зв'язку стає блукає по кристалу діркою, з якої пов'язаний одиничний покладе. заряд.
Електрони провідності і дірки - два типи вільних носіїв заряду в напівпровідниках. В ідеальних кристалах їх концентрації рівні, тому що перетворення одного з валентних електронів в електрон провідності неминуче викликає появу дірки. Електропровідність напівпровідників, обумовлена електронами атомів даної речовини (так звана власна провідність), визначається крім концентрації носіїв n їх рухливістю m-ставленням швидкості спрямованого руху, викликаного електричні. полем (дрейфовой швидкістю) νдр, до напруженості поля Е:
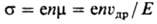
(Е-елементарний електричні. Заряд).
Рухливість різних носіїв в ідеальному кристалі визначається процесами розсіювання електронів на теплових коливаннях ґрат, тому ц сильно залежить від температури. При 300 К рухливість носіїв у твердих напівпровідниках варіюється в широких межах від 105 см2 / с до 10-3 см2 / с і менше. У реальних кристалах при знижених температурах, як правило, переважає розсіювання носіїв на дефектах кристалічної структури.
Домішкових провідність. У реальних кристалах джерелами вільних носіїв заряду (носіїв струму) можуть бути дефекти кристалічної структури, наприклад міжвузольні атоми, вакансії, а також відхилення від стехіометричного складу. Домішки і дефекти діляться на донори і акцептори. Донори віддають в обсяг напівпровідника надлишкові електрони, створюючи електронну провідність (n-типу). Акцептори захоплюють валентні електрони власних атомів напівпровідників, в результаті чого утворюються дірки і виникає діркова провідність (р-типу). Типовими донорами в Ge і Si є домішкові атоми елементів V гр. (Р, As, Sb). У вузлі кристалічної решітки 4 з 5 валентних електронів такого атома утворюють ковалентні зв'язки з сусідніми атомами Ge або Si, а 5-й електрон виявляється слабо пов'язаним з домішковим іоном. Енергія іонізації домішки мала (~ 0,01 еВ в Ge і 0,04 еВ в Si), тому вже при 77 К в напівпровідниках з'являються електрони провідності в концентрації, яка визначається вмістом домішки.
Аналогічно атоми III гр. (В, Al, Ga, In) -типові акцептори в Ge і Si. Дірка, яка залишається в місці захопленого домішкою валентного електрона Ge або Si, дуже слабо пов'язана з домішковим іоном і при не дуже низьких температурах легко перетворюється у вільний носій заряду (носій струму). У багатьох бінарних напівпровідниках типу AIVBVI джерелами дірок є вакансії атомів AIV, а вакансії BVI - джерелами електронів провідності. Електропровідність напівпровідників, обумовлена електронами домішкових атомів, називається примесной провідність, а введення певних домішок для отримання напівпровідників з різними необхідними властивостями - легированием напівпровідників.
Зонна теорія пояснює напівпровідникові властивості твердих тіл на основі одноелектронного наближення і розподілу електронних енергетичних рівнів у вигляді дозволених і заборонених зон (див. Тверде тіло ). Енергетичні рівні електронів, що беруть участь в ковалентного зв'язку, утворюють верхню із заповнених дозволених зон (валентну зону). Наступна по енергії дозволена зона, рівні якої не заповнені електронами, - зона провідності. Енергетичний інтервал між "дном" Ес (мінімумом енергії) зони провідності і "стелею" Еу (максимумом) валентної зони зв. шириною забороненої зони D E (див. рис.). Для різних напівпровідників ширина забороненої зони змінюється в широких межах. Так, при T: 0 До D E = 0,165 еВ в PbSe і 5,6 еВ в алмазі.
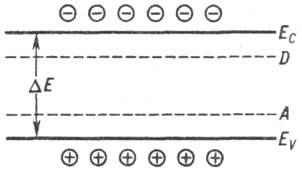
Валентна зона (гуртки з плюсом - дірки) і зона провідності (гуртки з мінусом -Електронна провідності): E з - дно зони провідності, EV- стелю валентної зони, D E - ширина забороненої зони, D і A -донорние і акцепторні рівні відповідно .
Тепловий рух переносить частину електронів в зону провідності; в валентної зоні при цьому з'являються дірки - квантові стану, не зайняті електронами. Зазвичай електрони займають рівні, розташовані поблизу дна Ес зони провідності, а дірки-рівні, розташовані поблизу стелі EV валентної зони. Відстані від цих рівнів відповідно до Ес і ЕV порядку енергії теплового руху k Т, т. Е. Набагато менше ширини дозволених зон (k-постійна Больцмана). Локальні порушення ідеальності кристала (домішкові атоми, вакансії та ін. Дефекти) можуть викликати утворення дозволених локальних рівнів енергії всередині забороненої зони.
При температурах поблизу 0 К все власні електрони напівпровідника знаходяться в валентної зоні, цілком заповнюючи її, а домішкові електрони локалізовані поблизу домішок або дефектів, так що вільні носії заряду відсутні. З підвищенням температури тепловий рух "викидає" в зону провідності переважно електрони домішкових атомів-донорів, оскільки енергія іонізації донора менше ширини забороненої зони. Концентрація електронів в зоні провідності при цьому у багато разів більше концентрації дірок у валентній зоні. В таких умовах електрони називаються основними носіями в напівпровіднику n-типу, аналогічно дірки - основними носіями в напівпровіднику р-типу. Після повної іонізації всіх донорів домінуючим процесом виявляється викид з валентної зони в зону провідності власних електронів. При деякій температурі їх концентрація в зоні провідності стає порівнянної з концентрацією домішкових електронів, а потім і в багато разів більшою. Це - температурна область власної провідності напівпровідника, коли концентрації електронів п і дірок р практично рівні.
Виникнення пари електрон провідності - дірка називається генерацією носіїв заряду. Можливий і зворотний процес - рекомбінація носіїв заряду, що приводить до повернення електрона провідності в валентну зону і зникнення дірки. Рекомбінація носіїв може супроводжуватися виділенням надлишкової енергії у вигляді випромінювання, що лежить в основі напівпровідникових джерел світла і лазерів.
Електрони провідності і дірки, виникнення яких стало наслідком теплових флуктуації в умовах термодинамічної рівноваги, називаються рівноважними носіями заряду. При наявності зовнішнього впливу на напівпровідники (освітлення, опромінення швидкими частинками, накладення сильного електричного поля) може відбуватися генерація носіїв заряду, що призводить до появи надлишкової (щодо термодинамічно рівноважної) їх концентрації. При появі в напівпровіднику нерівноважних носіїв зростає число актів рекомбінації і захоплення електрона з зони провідності на домішковий рівень в забороненій зоні ( "захоплення" носіїв). Після припинення зовнішнього впливу концентрація носіїв наближається до рівноважного значення.
pn-перехід в напівпровідниках. В обсязі одного і того ж напівпровідника можливе створення двох областей з різними типами провідності, наприклад легированием донорной домішкою (p -область) і акцепторною домішкою (n -область). Т к. В p-області концентрація дірок вище, ніж в n-області, відбувається дифузія дірок з р-області (в ній залишаються негативно заряджені акцепторні іони) і електронів з n-області (в ній залишаються позитивно заряджені донорні іони). На кордоні областей з р- і n -провідність утворюється подвійний шар просторів, заряду, і виникає електрична різниця потенціалів перешкоджає подальшій дифузії основних носіїв струму. В умовах теплового рівноваги повний струм через pn- перехід дорівнює нулю. Зовнішнє електричне поле порушує рівновагу, з'являється відмінний від нуля струм через перехід, який з ростом напруги експоненціально зростає. При зміні знака прикладеної напруги струм через перехід може змінюватися в 105-106 разів, завдяки чому pn- перехід є вентильним пристроєм, придатним для випрямлення змінного струму (напівпровідниковий діод). На властивості pn- переходу засноване застосування напівпровідників в якості різного роду датчиків - температури, тиску, освітлення, іонізуючих випромінювань (див. радіометрія ).
Класифікація напівпровідників. Відповідно до зонного теорією відмінність між напівпровідниками і діелектриками чисто кількісне - в ширині забороненої зони. Умовно вважають, що речовини з D E> 2 еВ є діелектриками, з D E <2 еВ - напівпровідниками. Настільки ж умовно поділ напівпровідників на вузькозонних (D E <0,1 еВ) і широкозонні. Важливо, що один і той же за хімічним складом матеріал в залежності від зовнішніх умов (перш за все температури і тиску) може проявляти різні властивості. Спостерігається певна залежність між концентрацією електронів провідності і стійкістю кристалічної структури напівпровідника. Зокрема, алмазоподібні структура стійка до тих пір, поки в зоні провідності ще залишаються вакантні енергетичні рівні. Якщо всі вони виявляються зайнятими і має місце виродження енергетичних рівнів , Перша координаційна сфера, а за нею і весь кристал зазнають перебудову з утворенням більш щільної структури, характерної для металів. При цьому концентрація електронів провідності перестає рости з температурою і власна провідність напівпровідника падає. Класичним прикладом є олово, стійка поліморфна модифікація якого (біле олово) при кімнатній температурі є металом, а стабільне при температурах нижче 13 ° С сіре олово (β-Sn) - вузькозонних напівпровідник. З підвищенням температури і відповідною зміною концентрації вільних електронів характерна для α-Sn алмазоподібні структура переходить в структуру з більш щільною упаковкою атомів, властивої металів. Аналогічний перехід напівпровідник -метал спостерігається при високій температурі у Ge, Si і алмазоподібних бінарних напівпровідників, які при плавленні втрачають напівпровідникові властивості.
В рамках зонної теорії аморфні (стеклообразниє і рідкі) напівпровідники можна розглядати як немолекулярное системи, в яких через різноманіття положень і взаємних орієнтації атомів і атомних груп положення дна (по енергії) зони провідності і стелі валентної зони відчувають флуктуації порядку ширини забороненої зони. В силу цього середньостатистичний енергетичний (потенційний) рельєф країв зон має складну форму, електрони в зоні провідності і дірки у валентній зоні локалізуються в потенційних ямах ( "краплях"), розділених різновисокими потенційними бар'єрами. Провідність в таких системах обумовлена спонтанним перебросом носіїв струму через бар'єр або квантовим туннелированием. До таких напівпровідників відносяться халькогенідні скла, що зберігають напівпровідникові властивості в рідкому стані.
У кристалічних напівпровідниках, що мають цепочечную (Se, Ті) або шарувату структуру (деякі модифікації As і Sb), зонна структура, а отже, ширина забороненої зони різні в різних кристалографічних напрямках, що зумовлено неоднаковим характером хімічного зв'язку. Виділяють гомодесміческіе напівпровідники з високосімметрічной структурою (Ge, Si, алмазоподібні бінарні і багатокомпонентні сполуки) і гетеродесміческіе напівпровідники (цепочечной і шаруватої структур, наприклад Se, Ті, GeAs, GeAs2). Сама величина власної провідності напівпровідників і її температурна залежність в різних кристалографічних напрямках для цих речовин (або фаз) будуть відрізнятися.
Напівпровідники і періодична система елементів. Елементи, що проявляють напівпровідникові властивості у вигляді простих речовин, розташовані компактною групою в періодичній системі (в таблиці вони виділені суцільною ламаною лінією). Всі вони є p-елементів, в атомах яких поступово заповнюються електронами p орбіталі. Власна провідність проявляється у речовин, структура яких допускає освіту насичених (двухцентрових) ковалентних зв'язків. У простих речовинах з валентними s- і p-електронів виконується так зване правило октету, згідно з яким кожен атом має (8- N) найближчих сусідів (N - номер групи). Так, в напівпровідниках групи IVa координаційне число дорівнює 4 (тетраедр). У напівпровідникових модифікацій простих речовин групи Va - P, As, Sb - координаційне число дорівнює 3, що сприяє формуванню шаруватих структур. S, Se, Ті (гр. VIa) в напівпровідниковому стані мають координаційне число 2 і утворюють лінійні, ланцюгові структури, пов'язані в тривимірну сітку силами Ван-дер-Ваальса. У напівпровідникової модифікації I (гр. VIIa) координаційне число дорівнює 1 і зберігається молекулярна структура з бінарними молекулами I2 в вузлах кристалічної решітки. У періодичної системі всі елементи, що утворюють напівпровідникові фази, крім В (гр. IIIa), розташовані правіше так званого кордону Цінтля, яка розділяє елементи з дефіцитом валентних електронів (менше 4 електронів на атом) і елементи, у яких достатня кількість валентних електронів для утворення ковалентних зв'язків в структурах простих речовин відповідно до правила октету.
кордон Цінтля
У бінарних сполуках між елементами, розташованими лівіше кордону Цінтля, і елементами, що стоять вправо від неї, реалізуються полярні ковалентні зв'язки. Зазвичай більш електроотріцатательний атом зв. "Аніонообразователем", більш електропозитивний - "катіонообразователем". Ці сполуки виявляють напівпровідникові властивості в тому випадку, якщо орбіталі аніонообразователя повністю заселені електронами. Напівпровідникові сполуки підкоряються модифікованому правилом октету, згідно з яким відношення числа nе валентних електронів, що припадають на одну формульну одиницю, до числа nа атомів елемента груп IVa-VIIa дорівнює 8. Склад таких з'єднань строго підпорядковується правилам формальної валентності. Найбільший інтерес представляють бінарні алмазоподібні фази, до складу яких входять елементи груп, рівновіддалених від гр. IVa. Вони утворюють так звані ізоелектронними ряди Si, Ge і a-Sn, члени яких представляють бінарні сполуки, в яких доводиться по 8 валентних електронів на одну формульну одиницю: ряд Si: AlP MgS NaCl ряд Ge: GaAs ZnSe CuBr ряд α-Sn: InSb CdTe AgI
З перерахованих з'єднань більшість має тетраедрічскую структуру (координаційне число 4), лише MgS і NaCl кристалізуються в структурі з координаційним числом 6, характерною для бінарних іонних кристалів, і є діелектриками. Напівпровідникові сполуки можуть утворюватися і при інших поєднаннях елементів, що знаходяться по різні боки кордону Цінтля ( 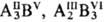 и т.п.
и т.п.
Існують фази, в структурі яких в першій координаційній сфері реалізуються зв'язку не тільки між різними атомами, але і між однаковими, в силу чого їх склад не підпорядковується правилам формальної валентності. Якщо катіонообразователем є елемент груп Ia - IIIa і в структурі фази є хімічні зв'язки між атомами цього елемента, то фаза є Металлиди (наприклад, Сu3Р, Cu3As). Якщо ж катіонообразователь - елемент груп IVa або Va, наявність зв'язку між його атомами не приводить до появи металевих властивостей. Напівпровідниками є і т. Зв. аніоно-надлишкові фази зі зв'язками між атомами-аніонообразователямі. Таким чином, напівпровідниками є GeAs і GeAs2 (одна зв'язок Ge-Ge і одна зв'язок As-As на одну формульну одиницю). Належність бінарної фази до напівпровідників регламентується формальним правилом Музера-Пірсона (ще одна модифікація правила октету): nе / nа + Ва = 8, де Ва - число зв'язків між аніонообразователямі. У структурі, що задовольняє цьому правилу, координаційні сфери кожного компонента формуються за допомогою двухелектронних зв'язків.
Уявлення, засновані на правилі насичення першої координаційної сфери, виявилися плідними для прогнозування напівпровідникових властивостей великого числа з'єднань, не тільки бінарних, але і багатокомпонентних. Шляхом заміщення компонентів бінарного напівпровідникового з'єднання атомами такий же валентності (ізовалентною заміщення) або ін. Валентності (гетеровалентності заміщення) можна отримувати безперервні і обмежені тверді розчини з напівпровідниковими властивостями. Прикладом можуть служити тверді розчини GaP-GaAs, AlP-GaP і ін. Потрійні напівпровідникові сполуки отримують шляхом заміщення двох атомів одного сорту в соед. типу AIIIBV на два атома з тієї ж сумарної валентністю. Наприклад, при заміщенні двох атомів алюмінію в АlР (сумарна валентність 3 + 3 = 6) на атоми Mg і Si (та ж сумарна валентність 2 + 4 = 6) отримують алмазоподібні потрійне напівпровідниковий соед. MgSiP2. Подібними фазами є ZnGeAs2, CdSnP2 і т.п., це так зване ізоелектронними заміщення.
Особливу групу речовин, здатних проявити напівпровідникові властивості, складають сполуки перехідних металів з елементами, розташованими праворуч від кордону Цінтля. Ці сполуки надзвичайно різноманітні за складом і властивостями через полівалентності перехідних d- і f -метал. У ряді випадків у реальних структурах можливо координаційне насичення хоча б одного компонента внаслідок утворення двох-електронних ковалентних зв'язків. В результаті знімається виродження енергетичних рівнів кристала і речовина стає напівпровідником. Оскільки всі елементи груп IVa - VIa належать до числа досить високо електронегативний, виконання зазначеного вище умови можливо у халькогенидов, фосфидов, арсенидів, силіцидів, особливо вищих, тобто що містять достатню кількість аніонообразователей в одній формульної одиниці. Напівпровідниковими властивостями володіють халькогеніди складу MX і МХ2, пніктіди (Фосфіди і арсеніди) цього ж складу, вищі силіциди (якщо вони не є фазами впровадження). Карбіди складу М2С, МС і деякі інші, як правило, металоподібними внаслідок того, що вони є фазами впровадження, т. Е. У них зберігається кристалічний каркас металевого компонента і, отже, переважає металевий характер хімічного зв'язку. Германіди, станід, багато (навіть вищі) антімоніди також є метали, оскільки входять до їх складу аніонообразователі недостатньо електронегативні.
Характерною особливістю практично всіх бінарних сполук перехідних металів з елементами груп IVa-VIa з напівпровідниковими властивостями є наявність виродження енергетичних рівнів при низьких температурах. Так, навіть такі яскраво виражені напівпровідники, як вищі силіциди CrSi2, ReSi2, Mn4Si7, виявляють позитивний коефіцієнт електричної провідності тільки при високих температурах. Це пов'язано не стільки з наявністю легко іонізуемих домішок, скільки з додатковою можливістю іонізації атомного остова перехідного металу, зумовленої його полівалентністю. У ряді випадків цей процес затягується аж до температури плавлення матеріалу, який так і не стає власним напівпровідником.
Органічні напівпровідники принципово відрізняються від неорганічних напівпровідників. Всі тверді неорганічні напівпровідники утворюють координаційні сполуки, в той час як органічні напівпровідники - молекулярні кристали . Вони так само, як і неорганічні напівпровідники, мають покладе. температурним коефіцієнтом провідності, але механізм провідності інший. Для органічних напівпровідників характерні багатоцентрові зв'язку, які характеризуються делокализацией p-електронів і проявом колективного електронної взаємодії по системі сполучення. Делокалізація електронів супроводжується виграшем енергії, званої енергією сполучення; це призводить, зокрема, до зменшення енергетичної щілини D Е між основним і нижчим порушеними станами p-електронів в міру збільшення числа сполучених зв'язків в молекулі. В полімерах з системою сполучення в основному ланцюзі макромолекули D Е може бути порядку енергії теплового руху kT. Зовнішній вплив (головним чином освітлення) викликає збудження в системі p-електронів, яке може мігрувати по кристалу і при розпаді (на дефектах структури, домішкових атомах, а також при взаємодії один з одним) дає вільні носії заряду. Провідність в органічних напівпровідниках забезпечується головним чином перескоками електронів між станами з різною енергією, причому дефіцит енергії покривається за рахунок енергії теплових коливань атомів (стрибкова провідність). З цим пов'язана характерна температурна залежність органічних напівпровідників: при помірно низьких температурах, коли домінують стрибки між сусідніми станами, між питомим електричним опором r і температурою Т спостерігається залежність ln r ~ T -1. Зі зниженням температури довжина стрибка збільшується і ln r ~ Т n (n <1).
Розрізняють чотири види органічних напівпровідників: 1) низькомолекулярні сполуки з конденсованими ароматичними ядрами: нафталін, антрацен, пірен, поручнів тощо і їх похідні; 2) з'єднання, що містять крім конденсованих ароматичних ядер откритоцепние ділянки (барвники і пігменти хлорофілу, β-каротину); 3) полімерні матеріали (поліетилен, біополімери); 4) молекулярні комплекси з переносом заряду, в яких провідність здійснюється шляхом переходу електрона від молекули-донора до молекули-акцептора (комплекси ароматичних сполук з галогенами). Багато органічні напівпровідники є біологічно активними речовинами, що, мабуть, нерозривно пов'язане з особливостями їх електричної провідності.
Літ .: Органічні напівпровідники, 2 вид., М., 1968; Горюнова Н.А., Хімія алмазоіодобних напівпровідників, Л., 1963; Угай Я. А., Введення в хімію напівпровідників, 2 вид., М., 1975.
© Я. А. Угай, В.З. Анохін.