Т. Діаграма стану - PhysBook
- Діаграма стану речовини Як уже зазначалося, одне і те ж речовина може перебувати в одному з трьох...
Діаграма стану речовини
Як уже зазначалося, одне і те ж речовина може перебувати в одному з трьох агрегатних станів в залежності від зовнішніх умов температури і тиску.
Залежність агрегатного стану речовини від тиску і температури може бути наочно представлена діаграмою стану. Для її побудови, відкладаючи по осі ординат тиск р, а по осі абсцис температуру Т, відзначають точками такі поєднання тиску p і температури Т, при яких знаходяться в динамічній рівновазі рідина - газ, газ - тверде тіло, рідина - тверде тіло.
Криві, що утворюються сукупністю цих точок (рис. 1), називаються відповідно: АК - крива випаровування (крива залежності температури кипіння рідини від тиску), СА - крива сублімації (крива кристалізації з пара), АВ - крива плавлення (крива кристалізації).
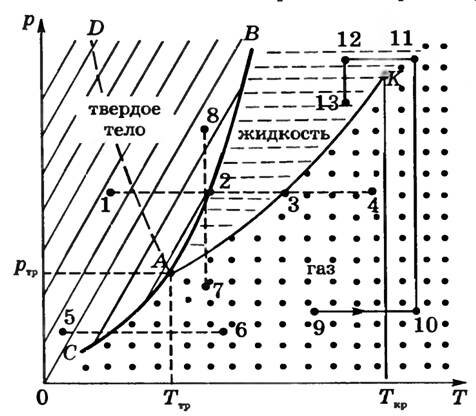
Мал. 1
Крива плавлення йде майже вертикально, відхиляючись кілька вправо. Це пов'язано з тим, що температура плавлення слабо залежить від тиску. Невелике відхилення вправо говорить про підвищення температури плавлення зі збільшенням тиску, що спостерігається у більшості речовин. Підвищення тиску як би перешкоджає переходу від більш щільною до меншої щільності упаковці частинок. Для речовин, що володіють в твердому стані менш щільною упаковкою частинок, ніж в рідкому стані (лід, вісмут, сірий чавун), збільшення тиску сприяє плавлення. Для таких речовин крива плавлення відхилена вліво від вертикалі (крива AD).
Зі зменшенням температури речовини, що знаходиться в кристалічному стані, зменшується і тиск його насиченої пари. Це відображено в ході кривої сублімації. Крива АЗ не случайно не доведена до перетину з віссю абсцис або ординат. Строго кажучи, при як завгодно низькій температурі, відмінній від абсолютного нуля, будь-яка речовина випаровується і з наближенням тиску до нуля має перейти в газоподібний стан. Однак у більшості хімічних елементів і їх з'єднань тиск насичених парів при низьких температурах дуже мало, а швидкість випаровування настільки низька, що речовина знаходиться в твердому або рідкому стані практично необмежено довго.
При значеннях тиску і температури, відповідних області, розташованої зліва від кривої CAB, речовина знаходиться в твердому стані, в області між кривими ВА і АК речовина знаходиться в рідкому стані, а в області, розташованої праворуч від кривої САК, речовина знаходиться в газоподібному стані.
На особливу увагу заслуговують точки А і К на діаграмі станів. Точка А, яка відповідає таким значенням тиску p тр і температури T тр, при яких знаходяться в динамічній рівновазі три фази - рідка, тверда і газоподібна, - називається потрійною точкою.
Значення p тр і T тр для деяких речовин наведено в таблиці. Істотною відмінністю для них є розташування потрійний точки на діаграмі щодо нормального атмосферного тиску. Якщо тиск в потрійній точці менше атмосферного (наприклад, для води 6 · 102 На), то речовина відноситься до плавиться. Воно при нагріванні спочатку плавиться і перетворюється в рідину, а потім вже переходить цілком у пар. Якщо тиск в потрійній точці більше атмосферного (наприклад, СO2 - 5,11 · 102 Па), то речовина відноситься до летючим. При нагріванні воно не плавиться, а переганяється (переходить в пар).
Речовина T тр, К p тр, Па СO2 216,5 5,11 · 102 NH3 195,4 6 · 103 H2O 273,16 6 · 102 O2 54,1 1,3 · 10
Діаграма стану для кожного конкретного речовини будується на підставі експериментальних даних. Знаючи діаграму стану, можна передбачити, в якому стані буде перебувати речовина при різних умовах, а також, які перетворення буде зазнавати речовина при різних процесах.
Наприклад, за умов, відповідних точці 1 (див. Рис. 1), речовина знаходиться в твердому стані. Якщо його піддавати Ізобаричний нагрівання, зображеному на діаграмі стану горизонтальної пунктирною 1-2-3-4, то при температурі, що відповідає точці 2, речовина плавиться, при більш високій температурі, відповідної точці 3, - починає перетворюватися в газ. Якщо ж речовина знаходиться в твердому стані, відповідному точці 5, то при изобарном нагріванні (пунктирна пряма 5-6) кристал перетворюється в газ, минаючи рідку фазу. Якщо ж речовина знаходиться в стані, відповідному точці 7, то при ізотермічному стисканні (пунктирна пряма 7-8) у воно пройде наступні три стану: газ - рідина - кристалічний стан.
Точка К на діаграмі станів відповідає критичного стану речовини і називається критичною точкою. При температурі вище критичної T кр ні при яких тисках речовина не переходить з газоподібного стану в рідке. При температурі вище критичної T кр зміна фізичних властивостей речовини з підвищенням тиску відбувається безперервно, без стрибків, відмінність між рідиною і газом зникає. Перетворення газу в рідину (або навпаки) без стрибкоподібного зміни властивостей речовини можливо, наприклад, шляхом, який показаний на діаграмі лінією 9-10-11-12-13. Перехід же кристалічного стану в рідке або газоподібне може бути тільки стрибкоподібним (за допомогою фазового переходу).
література
Аксеновіч Л. А. Фізика в середній школі: Теорія. Завдання. Тести: Учеб. посібник для установ, що забезпечують отримання заг. середовищ, освіти / Л. А. Аксеновіч, Н.Н.Ракіна, К. С. Фаріно; Під ред. К. С. Фаріно. - Мн .: Адукация i вихаванне, 2004. - C. 203-205.