глобулярні білки
78-79 


Біомолекули. Пептиди і білки
глобулярні білки
 На відміну від нерозчинних фібрилярних білків розчинні білки мають майже сферичну (глобулярную) форму. Глобулярним білкам властива високоупорядоченние просторова структура (конформація), яка сприяє виконанню специфічних біологічних функцій. В даному розділі розбираються особливості будови глобулярних білків на прикладі невеликого білка інсуліну (див. Сс. 82 , 162 ).
На відміну від нерозчинних фібрилярних білків розчинні білки мають майже сферичну (глобулярную) форму. Глобулярним білкам властива високоупорядоченние просторова структура (конформація), яка сприяє виконанню специфічних біологічних функцій. В даному розділі розбираються особливості будови глобулярних білків на прикладі невеликого білка інсуліну (див. Сс. 82 , 162 ).
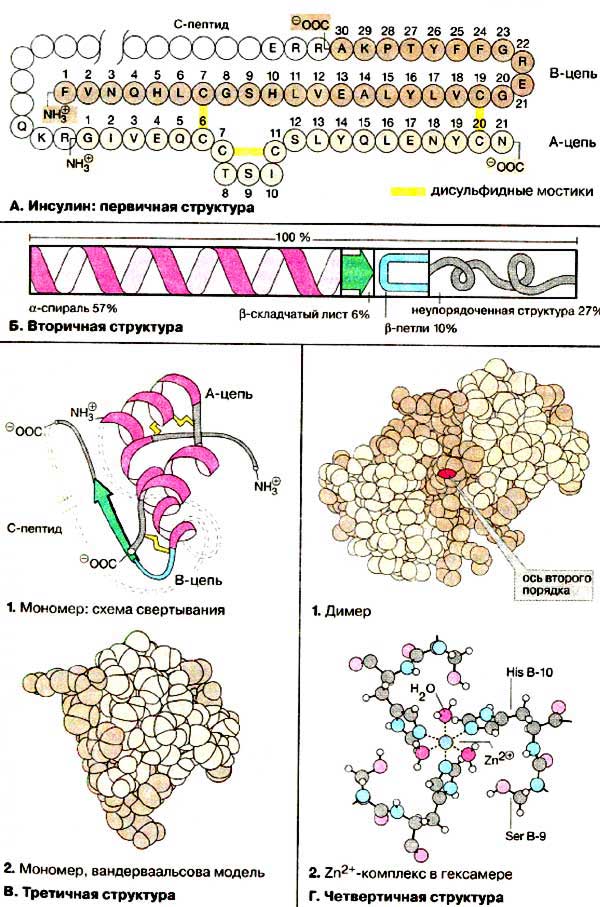
А. Інсулін: первинна структура
Під первинною структурою розуміють амінокислотну послідовність поліпептидного ланцюга. Інсулін був першим білком, будова якого було встановлено повністю ще на початку 50-х років. Молекула функціонально активного інсуліну складається з двох поліпептидних ланцюгів (А- і В-ланцюга), з'єднаних дисульфідними містками (на схемі А-ланцюг забарвлена в світло-коричневий колір, B-ланцюг - в темно-коричневий, дисульфідні містки - в жовтий). Додатковий дисульфідних місток локалізована в межах А-ланцюга. У підшлунковій залозі, де відбувається біосинтез інсуліну, спочатку синтезується білок-попередник - проінсулін, в якому С-кінцевий амінокислотний залишок В-ланцюга пов'язаний c Ν-кінцевим залишком А-ланцюга 33-членних фрагментом (на схемі не забарвлений). Після утворення в проінсуліну правильно замкнутих дисульфідних містків С-пептид відщеплюється протеолітичнимиферментами (див. С. 162 ).
Б. Вторинна структура
Вторинними структурами називаються ділянки поліпептидного ланцюга з упорядкованою конформацией, стабілізованою водневими зв'язками (див. С. 74 ). У більшості глобулярних білків присутні одночасно як α-спіралі, так і β-складчасті листи. Крім того, є ділянки з неврегульованою структурою. Поширеним структурним елементом глобулярних білків є β-петля.
У молекулі інсуліну ділянки, що мають форму α-спіралі, складають 57%, 6% припадає на β-складчасту структуру, 10% побудовано у вигляді β-петлі, що залишилися 27% не мають впорядкованої структури.
В. Третинна структура
Тривимірні функціонально активні конформації білків звуться третинної структури. Третинну структуру білків досліджують головним чином методом кристалографії. Цей трудомісткий метод заснований на дифракції рентгенівських променів на добре сформованих білкових кристалах. Ha підставі дифракційних картин розраховують розподіл електронної щільності в кристалі, а по електронній щільності відновлюють просторову структуру молекул білка з атомним дозволом. В даний час визначені тривимірні структури сотень білків. Однак багато білків поки не можна вивчити цим методом, оскільки їх не вдається отримати і вигляді добре сформованих кристалів досить великих розмірів.
Аналіз третинної структури інсуліну показав, що в Α-ланцюга є два коротких ділянки, а в В-ланцюга - один довгий ділянку, побудовані у вигляді α-спіралі (1). При цьому N-кінець А-ланцюга і С-кінець В-ланцюга розташовуються в безпосередній близькості один від одного. Єдина структура типу складчастого листа утворюється в димере інсуліну (див. Г, 4). Третинна структура проінсуліну ще не встановлена.
Г. Четвертичная структура
Білкові молекули часто утворюють симетрично побудовані комплекси, стабілізовані за рахунок нековалентнич взаємодій. Такі комплекси називаються олигомерами, а складові одиниці комплексів (від 2 до 12) - субодиницями або мономерами. Інсулін також утворює четвертинні структури. У крові інсулін присутній частково у вигляді димеру (1). Димер має вісь симетрії другого порядку. Крім того, в підшлунковій залозі в якості запасної форми міститься гексамерів інсуліну (з 6 мономерів), стабілізований іонами Zn2 + (див с. 162 ). В освіті двох комплексів з катіоном Zn2 + беруть участь залишки гістидину в положенні B-10 всіх шести субодиниць. На схемі 2 показано, що кожен октаедричному комплекс включає один катіон Zn2 +, три залишку гістидину і три молекули води (див. Також с. 83 ).


